Le fasi o gli stati sono le condizioni in cui si possono trovare determinate sostanze a seconda dei valori di pressione e temperatura. Nel caso ideale si usa l'equazione dei gas perfetti. Dove 'P' sta per pressione, 'V' per volume, 'n' per numero di moli e 'T' per temperatura. 'R' è una costante chiamata costante dei gas.
PV=nRT
Questa volta parliamo di chimica dei materiali. I materiali sono presenti in diverse fasi che tutti ricordiamo dalle elementari più qualcuna nuova. La fase gassosa è quella dove gli atomi hanno maggiore libertà: l'energia cinetica è tale da farli cozzare contro le pareti del recipiente rendendoli quindi dotati di una pressione. A temperatura ambiente ogni mole di gas occupa uno stesso volume fissato chiamato volume molare di 22,4l. La temperatura influisce sulla energia cinetica delle molecole aumentandone il moto vibrazionale e di traslazione, in questo modo le molecole premono maggiormente sulle pareti del contenitore.
Poi c'è lo stato liquido dove è presente un ordine a corto raggio e un disordine a lungo raggio; nello stato liquido le particelle risentono di alcune delle interazioni deboli che mantengono l'ordine sino a cinque-sei distanze molecolari. Il liquido è uno stato speciale caratterizzato dalla incomprimibilità. secondo l'equazione di Van der Waals che è una complicazione dell'equazione di stato, in quelle determinate temperature il gas reagirebbe a un aumento di pressione con un aumento di volume. In realtà ciò è inaccettabile così una parte di gas diventa liquido e l'altra rimane gassosa. Liquidi e gas formano un unico stadio chiamato supercritico.
Esiste poi lo stato solido in cui le molecole sono impacchettate in modo ordinato formando strutture che prendono il nome di cristalli. Ove una cella elementare è ripetuta come modulo nello spazio. Nei cristalli le molecole sono tenute in posizione ordinata da forze deboli e di Van der Waals. Esistono poi dei solidi cosiddetti amorfi dove le molecole non sono disposte in modo ordinato, come il vetro; tuttavia essi sono classificati tra i liquidi. Infatti vengono considerati liquidi molto viscosi in cui le forze di coesione tra le molecole rendono l'aspetto solido. I solidi sono uno stato ordinato della materia. In realtà lo stato ordinato risulta quello a minore energia. Quando un solido passa direttamente allo stato gassoso si parla di sublimazione. lo iodio e il naftalene ad esempio sono materiali che sublimano a determinati valori di pressione e temperatura. Nel caso del naftalene, ciò ad esempio è dovuto ai legami estrememente deboli presenti in questa sostanza. Solamente forze di Van der Waals. L'anidride carbonica viene spesso pressurizzata a temperatura ambiente per essere portata allo stato solido, quello che si chiama ghiaccio secco e poi utilizzata per effetti di fumo sui palchi dei concerti.
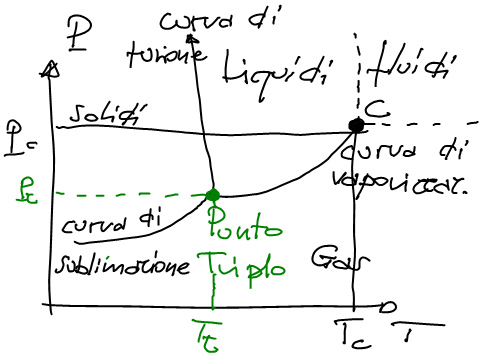
L'ultimo stato della materia che noi consideriamo è lo stato supercritico, che corrisponde a uno stato intermedio tra liquido e gas in cui sono presenti interazioni tra le molecole, ma le molecole tendono a diffondersi in tutto il volume possibile come un gas. questo stato si assume a partire da un determinato valore di pressione e temperatura chiamato punto critico. essendo attive le forze deboli, un materiale allo stadio supercritico può fungere da solvente come un liquido!
Fissato un volume di sostanza a portare le molecole in uno o in un altro stato ci pensano la pressione e la temperatura. Un piano R2 con le coppie ordinate di pressione e temperatura si chiama 'diagramma di stato'. Lungo gli spazi i materiali sono presenti in una fase prefissata. Lungo le linee, valori differenti di pressione e temperatura possono influenzare lo stato dei materiali. esiste poi un punto chiamato punto triplo in cui è presente l'equilibrio tra tutte e tre le fasi. La curva che vedete è anomala perchè riferita all'acuq; l'acqua e il bismuto infatti tendono ad avere la linea tra solidi e liquidi a pendenza negativa che vale a dire che il solido(ghiaccio) occupa più volume del liquido(acqua). Normalmente questa linea ha pendenza positiva cioè dasinistra verso destra. Il passaggio da solido a liquido, da solido a gas e da liquido a gas richiede temperatura. per questo quando l'alcool o l'acqua evapora a contatto con la pelle percepiamo una sensazione di ffreddo. L'energia passa dal corpo a maggiore temperatura a quello a minore temperatura consentendo il passaggio di fase.
Prendendo un liquido, tuttavia sappiamo che una parte di esso si trasforma in vapore e una parte di vapore si ricondensa in base a quella che si chiama tensione di vapore. Mai pensare quindi che un determinato campione sia completamente in una fase. una parte di esso potrà trovarsi in altre fasi a seconda dell'energia cinetica media delle molecole.